- Groupe Monocytes-inflammation-NGF
(Coordinateurs : Véronique Freund-Michel (PU) et Clément Bouchet (CDD-LRU), Participants : Arnaud MAURAC (PH)) - Groupe Canaux mécanosensibles et polluants particulaires
(Coordinateurs : Isabelle Baudrimont (PU), Thomas Ducret (PU) et Jean-François Quignard (PU)) - Personnel technique : Marilyne CAMPAGNAC (TCH),Paul ROBILLARD (TCH), Benjamin PÉRÉ (TCH)
L’hypertension pulmonaire (HTP), définie par une élévation de la pression artérielle pulmonaire au‑delà de 20 mmHg, est une comorbidité cardiovasculaire fréquente de la bronchopneumopathie chronique obstructive (BPCO). La BPCO touche plus de 200 millions de personnes et le développement d’une HTP entraine chez ces patients des coûts médicaux plus élevés et une réduction de la survie à 5 ans par rapport aux patients atteints de BPCO sans HTP ou par rapport aux patients présentant d’autres formes d’HTP. Les mécanismes physiopathologiques impliqués dans le développement d’une HTP chez les patients atteints de BPCO (HTP-BPCO) ne sont pas clairement identifiés et aucun traitement spécifique n’est disponible actuellement.
Par ailleurs, l’exposition humaine aux particules atmosphériques est une préoccupation majeure de santé publique. De nombreuses études épidémiologiques ont en effet révélé l’implication des PM (Particulate Matter) et des nanoparticules (NPs) dans le déclenchement ou l’exacerbation de maladies respiratoires comme la BPCO, ou de maladies cardiovasculaires comme l’HTP et l’insuffisance cardiaque. Les patients souffrant d’HTP-BPCO pourraient donc constituer une population à risque lors de l’exposition aux particules atmosphériques.
Nos objectifs sont de mieux comprendre les mécanismes physiopathologiques de l’HTP-BPCO afin d’identifier de nouvelles cibles thérapeutiques potentielles. Compte-tenu du très mauvais pronostic des patients atteints d’HTP-BPCO et du faible nombre d’études sur ce groupe de patients à l’heure actuelle, l’HTP-BPCO représente un véritable enjeu en termes de Santé Publique. Ainsi, identifier de nouvelles cibles thérapeutiques pourrait permettre le développement de traitements innovants qui pourraient avoir un impact majeur pour la prise en charge de ces patients. Nous évaluerons également les conséquences de l’exposition aux particules de la pollution sur la circulation pulmonaire.
Groupe Monocytes-inflammation-NGF
Nos précédents travaux avaient montré une expression pulmonaire accrue du facteur de croissance des nerfs (NGF) chez les patients atteints d’HTP-BPCO en comparaison à des patients contrôles, et un rôle du NGF en particulier dans le remodelage, l’inflammation et les altérations de la réactivité des artères pulmonaires (Freund-Michel et al, 2015).
- Nos travaux récents ont identifié des mécanismes activés par le NGF pour participer à l’hyperréactivité artérielle pulmonaire, via l’activation de son récepteur TrkA exprimé sur les cellules musculaires lisses artérielles pulmonaires. Le NGF module en chronique l’expression et l’activité de la Connexine-43 (Cx43) (Cardouat et al, 2024), alors qu’il augmente en aigu les concentrations de calcium dans ces cellules et sensibilise leur appareil contractile au calcium (Bouchet et al, en cours de soumission).
- Nous avons également montré que l’inflammation était une des conditions physiopathologiques dans l’HTP qui pouvait contribuer à l’augmentation des taux de NGF dans cette pathologie (Bouchet et al, 2022). Nous étudions maintenant les interactions potentielles entre NGF et monocytes, des cellules inflammatoires particulièrement impliquées dans la physiopathologie de la BPCO et de l’HTP. Nous avons ainsi montré que le NGF stimule la libération par les monocytes de cytokines pro‑inflammatoires et de facteurs impliqués dans le remodelage artériel pulmonaire (Verres et al, 2024).
- Enfin, en collaboration avec le groupe BPCO de l’Equipe 2 de l’Unité, nous avons participé au développement et à la caractérisation d’un nouveau modèle de BPCO précoce. Nous avons mis en évidence un rôle de l’axe CXCL12-CXCR4 dans le remodelage cardiaque droit présent dans ce modèle (Dupin et al, 2025).
Groupe Canaux mécano-sensibles et polluants particulaires
Nos précédents travaux ont montré une altération de l’homéostasie calcique intracellulaire au cours de l’HTP. En effet, nous avons mis en évidence le rôle de canaux ioniques dans le développement de l’HTP et notamment les canaux mécano-sensibles (ou stretch-activated channels) de type TRP et Piezo (TRPV4 et Piezo1 en particulier). Ces canaux, en laissant transiter du calcium, permettent de convertir un stimulus physique (pression sanguine, force de cisaillement due au flux sanguin ou rigidité de l’environnement cellulaire) en une réponse biologique. Ils sont donc impliqués dans l’homéostasie calcique intracellulaire.
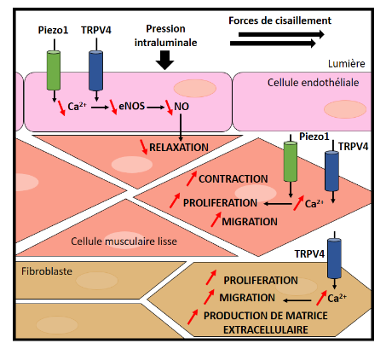
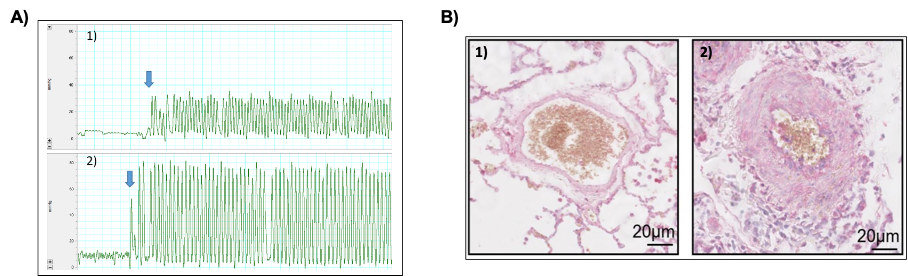
(D’après Barbeau et al, Rev Mal Respir 2022).
Nous avons montré que l’expression des canaux TRPV4 et Piezo1 varie au cours de l’HTP tant au niveau des cellules musculaires lisses, des cellules endothéliales, que des fibroblastes de l’adventice artérielle. Ils sont ainsi impliqués dans des phénomènes majeurs dans l’HTP comme la modulation du tonus vasculaire, la prolifération/migration cellulaire ou l’inflammation. Ces canaux pourraient donc être des cibles dans le traitement de l’HTP (Barbeau et al, 2021).
Grâce à une collaboration avec le Dr Percherancier (Université de Bordeaux), nous avons développé de nouvelles sondes utilisables avec la technique du transfert d’énergie en résonance de bioluminescence (BRET) : des sondes intermoléculaires, pour évaluer les interactions protéiques et notamment la relocalisation des canaux, et des sondes intramoléculaires permettant d’étudier les changements conformationnels des canaux ou le passage des ions directement dans le nanoenvironnement du pore (Chappe et al, 2021 ; Chappe et al, 2022). Ces sondes nous ont ainsi permis de montrer que l’hypoxie était capable de moduler l’expression de TRPV4 à la membrane plasmique, cette dernière étant affectée par la confluence cellulaire (Barbeau et al, 2022).
En parallèle, nos travaux ont montré que des NPs de noir de carbone (FW2) et d’oxyde de nickel (NiONPs) induisent, sur des cellules endothéliales artérielles pulmonaires humaines (HPAEC), un stress oxydant ainsi qu’une réponse adaptative de la cellule au stress oxydant, à l’origine d’une altération de l’homéostasie calcique intracellulaire (altérations des canaux TRPV4), d’une dysfonction mitochondriale et du déclenchement d’un processus apoptotique (Deweirdt et al, 2020, Germande et al, 2022a) (Collaborations avec le Pr Baeza, Université Paris Diderot, et le Pr Baudrimont, Université de Bordeaux). Nous avons aussi montré que ces effets sont potentialisés lorsque les cellules sont placées en conditions pathologiques mimant la dynamique vasculaire observée dans l’HTP, suggérant que l’exposition aux FW2 et aux NiO NPs pourrait aggraver certains événements physiopathologiques chez les patients souffrant d’HTP (Germande et al, 2022b, Deweirdt et al, 2022).
Enfin, une étude novatrice a permis de montrer que le potentiel oxydant intrinsèque des PM2.5 pourrait être utilisé comme indicateur prédictif de la toxicité des PM. De plus, ces particules fines induisent une surproduction d’espèces réactives dérivées de l’oxygène (ERO) à l’origine d’un déséquilibre rédox conduisant à une altération de la biodisponibilité du monoxyde d’azote (NO) et de l’homéostasie calcique qui pourraient être à l’origine d’une dysfonction endothéliale (Crobeddu et al, 2020) (Collaboration avec le Pr Baeza, Université Paris Diderot).
Projets en cours
Groupe Monocytes-inflammation-NGF
- Rôle de l’interleukine-1β dans les effets physiopathologiques du NGF dans l’HTP
Coordinatrice : Véronique Freund-Michel
Collaboration avec le Pr Katia Boniface (Laboratoire ImmunoConcept, CNRS UMR5164, Bordeaux) - Caractérisation des monocytes circulants des patients HTP-BPCO
Coordinateur : Clément Bouchet
Collaboration avec le Pr Maéva Zysman (Groupe BPCO Equipe 2 de l’Unité, et coordinatrice de la cohorte COBRA comprenant des patients BPCO ± HTP) - Rôle de l’axe inflammatoire NGF-TrkA-monocytes dans le développement de l’HTP et de l’insuffisance cardiaque droite associée chez les patients atteints de BPCO
Coordinatrice : Véronique Freund-Michel
Collaborations avec le Pr Maéva Zysman (Groupe BPCO Equipe 2 de l’Unité, et coordinatrice de la cohorte COBRA) et avec le Pr Jean Guillon (Equipe BALI, Laboratoire ARNA, INSERM U1212- UMR CNRS 5320, Bordeaux) - Rôle de l’interaction miR-147-BDNF dans les pathologies vasculaires
Coordinatrice : Véronique Freund-Michel
Collaboration avec le Pr Andreas Schober (Groupe de Médecine Vasculaire de l’Institut de Prévention Cardiovasculaire, Hôpital Universitaire de la Ludwig-Maximilians-Universität de Munich – LMU Munich, Allemagne) - Identification de biomarqueurs sanguins permettant de discriminer efficacement les patients atteints de BPCO de ceux atteints d’HTP-BPCO
Coordinateur : Clément Bouchet
Collaborations avec le Pr Maéva Zysman (Groupe BPCO Equipe 2 de l’Unité, et coordinatrice de la cohorte COBRA) et avec les Pr David Montani et Laurent Savale (INSERM UMR-S999, Le Plessis Robinson)
Groupe Canaux mécano-sensibles et polluants particulaires
- Caractérisation des canaux mécano-sensibles grâce au transfert d’énergie en résonance de bioluminescence
Coordinateur : Thomas Ducret
Collaboration avec le Dr Yann Percherancier (Laboratoire de l’Intégration du Matériau au Système (IMS), CNRS UMR5218, Université de Bordeaux) - Identification de nouvelles molécules d’origine naturelle, issues de la biodiversité végétale brésilienne, dans le traitement de l’HTP ayant pour cible les canaux ioniques mécano-sensibles
Coordinateur : Jean-François Quignard
Collaboration avec le Pr Isaac Medeiros (Laboratoire de pharmacologie, Université fédérale de la Paraiba, Joao Pessoa, Brésil) - Rigidité matricielle et canaux mécano-sensibles Piezo1
Coordinateur : Jean-François Quignard
Collaboration avec le Dr Alexandra Gaubert (Laboratoire Acides nucléiques : Régulations naturelles et artificielles (ARNA) – INSERM U1212/UMR CNRS 5320, Equipe ChemBioPharm, Université de Bordeaux) - Impact de différents types de nanoparticules sur la réactivité artérielle pulmonaire
Coordinatrice : Isabelle Baudrimont
Financements
Groupe Monocytes-inflammation-NGF
- Programme « Initiative d’excellence » (Idex) « LMU-Bordeaux Research Cooperation Program » – Véronique Freund-Michel
- Programme de Recherche « Danièle Hermann – Cœur de femmes » de la Fondation Recherche Cardio‑vasculaire de l’Institut de France – Véronique Freund-Michel
- Programme « Recherche, formation ou évaluation » du Fonds sur les maladies chroniques nécessitant une assistance médico-technique, Fondation Bordeaux Université – Véronique Freund-Michel
- Programme « Urgences de la Recherche, Physiopathologie cardiovasculaire » de la Fondation pour la Recherche Médicale – Véronique Freund-Michel
- Bourse de la Fondation pour la Recherche Médicale FRM « Prix Jeanne-Philippe Béziat 2020 » pour le financement d’une thèse de doctorat (pour C. Bouchet) – Véronique Freund-Michel
- Allocation de fin de thèse du Groupe de Réflexion sur la Recherche Cardiovasculaire (GRRC), Filiale de la Société Française de Cardiologie (SFC) (pour C. Bouchet) – Véronique Freund-Michel
- Fondation du souffle « Plates-formes et recherche en santé respiratoire » – Christelle Guibert/Véronique Freund-Michel
Groupe Canaux mécano-sensibles et polluants particulaires
- Projet de Recherche Collaborative – Entreprise de l’Agence Nationale de la Recherche (ANR-PRCE)- CANALBRET – Thomas Ducret/Jean-François Quignard
- Région Nouvelle Aquitaine – Enseignement supérieur et recherche (ESR) – PHYSTRIG – Thomas Ducret/Jean-François Quignard
- Bourse de mobilité Département STS, Université de Bordeaux (Pr. Isaac Medeiros) – Jean-François Quignard
- Bourse sandwich de doctorat (pour J. De Souza Junior), Université fédérale de la Paraiba, Brésil – Jean-François Quignard
- Bourse de la Fondation pour la Recherche Médicale FRM « Prix Mariane Josso » pour le financement d’une thèse de doctorat (pour J. Deweirdt) – Isabelle Baudrimont
- ANR- PRC CYTOTOX – Isabelle Baudrimont
Principales références bibliographiques
- Dupin I, Henrot P, Maurat E, Abohalaka R, Chaigne S, El Hamrani D, Eyraud E, Prevel R, Esteves P, Campagnac M, Dubreuil M, Cardouat G, Bouchet C, Ousova O, Dupuy JW, Trian T, Thumerel M, Bégueret H, Girodet PO, Marthan M, Zysman M, Freund-Michel V, Berger P. Blocking CXCR4 improves pulmonary and cardiac outcomes in a mouse model of early COPD. American Journal of Respiratory Cell and Molecular biology 2025 ; Online ahead of print.
- Cardouat G, Douard M, Bouchet C, Roubenne L, Kmecová Z, Esteves P, Brette F, Guignabert C, Tu L, Campagnac M, Robillard P, Coste F, Delcambre F, Thumerel M, Begueret H, Maurac A, Belaroussi Y, Klimas J, Ducret T, Quignard JF, Vacher P, Baudrimont I, Marthan R, Berger P, Guibert C#, Freund Michel V#. NGF increases Connexin-43 expression and function in pulmonary arterial smooth muscle cells to induce pulmonary artery hyperreactivity. Biomedicine & Pharmacotherapy 2024 ; 174 : 116552. #contribution égale en tant que dernier auteur.
- Verres Y, Bodin A, Chevret S, Victoni T, Gicquel T, Barreto E, Freund-Michel V, Lagente V. Effects of the nerve growth factor and its carrier protein on the inflammatory response from human monocytes. Fundamental and Clinical Pharmacology 2024 ; 38 : 940.
- Barbeau S, Porto Ribeiro T, Gilbert G, Cardouat G, Baudrimont I, Freund-Michel V, Guibert C, Marthan R, Vacher P, Quignard J-F, Ducret T. Involvement of the Piezo1 and TRPV4 stretch-activated channels in pulmonary hypertension. Revue des Maladies Respiratoires 2022 ; 39 : 79.
- Barbeau S, Joushomme A, Chappe Y, Cardouat G, Baudrimont I, Freund-Michel V, Guibert C, Marthan R, Berger P, Vacher P, Percherancier Y, Quignard J-F, Ducret T. Cell Confluence Modulates TRPV4 Channel Activity in Response to Hypoxia. Biomolecules 2022 ; 12 : 954.
- Bouchet C, Cardouat G, Douard M, Coste F, Robillard P, Delcambre F, Ducret T, Quignard JF, Vacher P, Baudrimont I, Marthan R, Berger P, Guibert C#, Freund-Michel V#. Inflammation and Oxidative Stress Induce NGF Secretion by Pulmonary Arterial Cells through a TGF-β-Dependent Mechanism. Cells 2022 ; 11 : 2795. #contribution égale en tant que dernier auteur.
- Chappe YL, Pierredon S, Joushomme A, Molle P, Garenne A, Canovi A, Barbeau S, Poulletier De Gannes F, Hurtier A, Lagroye I, Ducret T, Quignard J-F, Compan V, Percherancier Y. Genetically-encoded BRET probes shed light on ligand bias-induced variable ion selectivity in TRPV1 and P2X5/7. Proceedings of the National Academy of Sciences of the United States of America (PNAS) 2022 ; 119 : e2205207119.
- Deweirdt J, Ducret T, Quignard J-F, Freund-Michel V, Lacomme S, Gontier E, Muller B, Marthan R, Guibert C, Baudrimont I. Effects of FW2 Nanoparticles Toxicity in a New In Vitro Pulmonary Vascular Cells Model Mimicking Endothelial Dysfunction, Cardiovascular Toxicology 2022 ; 22 : 14.
- Germande O, Baudrimont M, Beaufils F, Freund-Michel V, Ducret T, Quignard J-F, Marie-Hélène E, Lacomme S, Gontier E, Mornet S, Bejko M, Muller B, Marthan R, Guibert C, Deweirdt J# Baudrimont I#. NiONPs-induced alteration in calcium signaling and mitochondrial function in pulmonary artery endothelial cells involves oxidative stress and TRPV4 channels disruption. Nanotoxicology 2022a ; 16 : 29. #contribution égale en tant que dernier auteur.
- Germande O, Ducret T, Quignard J-F, Deweirdt J, Freund-Michel V, Errera MH, Cardouat G, Vacher P, Muller B, Berger P, Guibert C, Baudrimont M#, Baudrimont I#. NiONP-Induced Oxidative Stress and Mitochondrial Impairment in an In Vitro Pulmonary Vascular Cell Model Mimicking Endothelial Dysfunction. Antioxidants 2022b ; 11 : 847. #contribution égale en tant que dernier auteur.
- Barbeau S, Gilbert G, Cardouat G, Baudrimont I, Freund-Michel V, Guibert C, Marthan R, Vacher P, Quignard J-F, Ducret T. Mechanosensitivity in Pulmonary Circulation: Pathophysiological Relevance of Stretch-Activated Channels in Pulmonary Hypertension. Biomolecules 2021 ; 11 : 1389.
- Chappe Y, Michel P, Joushomme A, Barbeau S, Pierredon S, Baron L, Garenne A, Poulletier De Gannes F Hurtier A, Mayer S, Lagroye I, Quignard J-F, Ducret T, Compan V, Franchet C, Percherancier Y. High-throughput screening of TRPV1 ligands in the light of the Bioluminescence Resonance Energy Transfer technique. Molecular Pharmacology 2021 ; 100 : 237.
- Crobeddu B, Baudrimont I, Deweirdt J, Sciare J, Badel A, Camproux AC, Bui LC, Baeza-Squiban A. Lung Antioxidant Depletion: A Predictive Indicator of Cellular Stress Induced by Ambient Fine Particles. Environmental science and technology 2020 ; 54 : 2360.
- Deweirdt J, Quignard J-F, Lacomme S, Gontier E, Mornet S, Savineau J-P, Marthan R, Guibert C, Baudrimont I. In vitro study of carbon black nanoparticles on human pulmonary artery endothelial cells: effects on calcium signaling and mitochondrial alterations. Archives of toxicology 2020 ; 94 : 2331.
- Freund-Michel V, Cardoso Dos Santos M, Guignabert C, Montani D, Phan C, Coste F, Tu L, Dubois M, Girerd B, Courtois A, Humbert M, Savineau JP, Marthan R, Muller B. Role of Nerve Growth Factor in Development and Persistence of Experimental Pulmonary Hypertension. American Journal of Respiratory and Critical Care Medicine 2015 ; 192 : 342.
