Coordinateurs : Christelle Guibert (DR INSERM), Thomas Ducret (PU), Jean-François Quignard (PU), Guillaume Cardouat (MCF), Eric Dumas De La Roque (PH), Claire-Marie Pilard (PH)
Participants : Solène Barbeau (post-doctorante), Laure Gassiat (doctorante), Frédéric Coatleven (PH), Sophie Martin-Berenguer (PH), Melie Sarreau (PH)
Personnel technique : Isabel Gauthereau (IGE),Paul Robillard (TCH), Marilyne Campagnac (TCH), Benjamin Péré (TCH), Alexis Leriche (AI – CDD)
La dysplasie bronchopulmonaire (DBP) est la principale complication respiratoire du nouveau-né grand prématuré. Elle est la conséquence de multiples agressions périnatales comme l’inflammation prénatale, le retard de croissance intra-utérin (RCIU), les baro- et volotraumatismes associés à la ventilation mécanique post-natale et le stress oxydatif en lien avec l’oxygénothérapie. Sur le plan histologique, elle est principalement caractérisée par un arrêt du développement alvéolaire (hypoplasie alvéolaire) et vasculaire (hypoangiogenèse) associé à une inflammation et un stress oxydant majeurs. Cette DBP affecte entre 30 à 70 % des nouveau-nés grands prématurés, et 25 à 40 % des nouveau-nés prématurés ayant une DBP sévère vont développer une hypertension pulmonaire (HTP-DBP). L’HTP-DBP est la complication la plus sévère de la DBP. En effet, l’HTP-DBP persistante sur les premiers mois de vie est responsable d’une surmortalité de l’ordre de 40 à 50% dans les 2 ans suivant le diagnostic. Du fait des progrès des techniques réanimatoires permettant la survie d’enfants de plus en plus prématurés, la DBP est devenue un véritable problème de santé publique. De plus, la DBP est une maladie pulmonaire qui a également des conséquences à long terme pour la santé à l’âge adulte avec notamment une susceptibilité accrue à développer des maladies pulmonaires (asthme), vasculaires (HTP), cardiaques (troubles du rythme) et neuronales (troubles cognitifs). Enfin, à ce jour, aucun traitement préventif ou curatif n’est disponible pour 1) la prise en charge des enfants avec une DBP associée ou non à une HTP, et 2) les enfants survivants à la DBP afin de restaurer leur fonction pulmonaire et éviter les séquelles à l’âge adulte. L’amélioration de nos connaissances sur la physiopathologie de cette maladie est donc cruciale afin de proposer des stratégies thérapeutiques adaptées.
Travaux récents
Nous disposons au laboratoire d’un premier modèle de raton exposé à l’hyperoxie chronique en période néonatale (14 jours en hyperoxie O2 90%) qui reproduit la pathologie humaine de l’HTP-DBP (figure 1 gauche) (Dumas de la roque et al., 2017). Pour déterminer les conséquences de l’HTP-DBP à moyen et long termes, les animaux sont étudiés à 14 jours, 60 jours (jeune adulte) et 180 jours (adulte).
De plus, grâce à une collaboration avec la maternité et le service d’anatomo-pathologie du CHU de Bordeaux, nous avons accès à des poumons et cordons ombilicaux de fœtus ayant eu une interruption médicale de grossesse. Ces tissus nous permettent d’isoler des cellules musculaires lisses d’artères pulmonaires humaines fœtales ainsi que des cellules endothéliales vasculaires… Grâce à un incubateur à hyperoxie, nous conditionnons ces cellules en hyperoxie (60 % pendant 48h) pour étudier l’effet de l’oxygène sur ces cellules (figure 1, droite).
Ainsi, nous avons récemment montré que le célastrol, une molécule anti-inflammatoire et antioxydante issue de la médecine chinoise, améliore considérablement la survie des ratons. Cette molécule prévient l’HTP-DBP et pourrait constituer un nouvel outil thérapeutique (Pilard et al., 2025).
Nous avons récemment montré que le célastrol, une molécule anti-inflammatoire et antioxydante issue de la médecine chinoise, améliore considérablement la survie des ratons. Cette molécule prévient l’HTP-DBP et pourrait constituer un nouvel outil thérapeutique (Pilard et al., 2025).
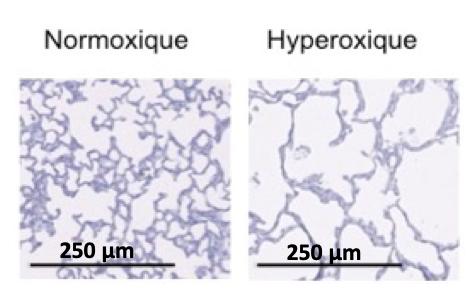
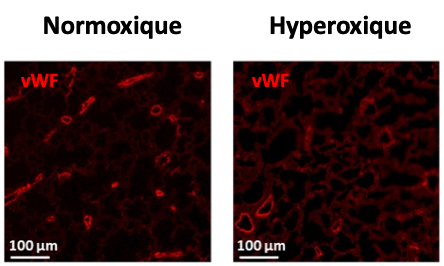
Figure 2 : Alvéolisation (coloration HES – gauche) et densité vasculaire (marquage fluorescent de l’endothélium au facteur de von Willebrand en rouge – droite) en conditions normoxiques et hyperoxiques chez le raton à 14 jours de vie.
Projets en cours
- Remodelage structurel et électrophysiologique du ventricule droit (Coordinatrice : Claire-Marie Pilard)
- Rôle de l’ostéoprotégérine (OPG) (Coordinateur : Thomas Ducret)
- Rôle de la thrombomoduline (Coordinatrice : Christelle Guibert)
- Rôle du récepteur GPRX (Coordinateur : Guillaume Cardouat)
- Identification de nouvelles molécules d’origine naturelle, issues de la biodiversité végétale brésilienne et ayant pour cible les canaux ioniques mécano- sensibles, dans le traitement de l’HTP-DBP (Coordinateur : JF Quignard) – Collaboration avec le Pr Isac Medeiros (laboratoire de pharmacologie, Université fédérale de la Paraiba, Brésil)
Financements
- Revenus du brevet hemangiol – Eric Dumas De La Roque/Christelle Guibert
- Recherche en néonatologie – Société française de néonatologie – Claire-Marie Pilard
- ANR – Endosurf – Eric Dumas De La Roque
- Prématuration – Guillaume Cardouat
- Diverses bourses du département STS (mobilité entrante, équipement mutualisé) – Jean-François Quignard/Christelle Guibert – collaboration avec le Prof. Isaac Medeiros, Brésil
- Bourse de la Fondation pour la Recherche Médicale FRM – programme « FDM – Poste de thèse pour internes et assistants » pour Claire-Marie Pilard
- Programme « Recherche, formation ou évaluation » du Fonds sur les maladies chroniques nécessitant une assistance médico-technique, Fondation Bordeaux Université – Christelle Guibert
Principales références bibliographiques
- Pilard C.M., Cardouat G., Gauthereau I., Gassiat L., DuboisM., Robillard P., Sauvestre F., Pelluard F., Berenguer S., Sarreau M., Claverol S., Tokarski C., Sentilhes L., Coatleven F., Vincienne M., Marthan R., Dumas-de-la-Roque E., Berger P., Friedberg M.K., Renesme L., Freund-Michel V.*, Guibert C.*- * co-derniers auteurs. Celastrol has beneficial effects on pulmonary hypertension associated with bronchopulmonary dysplasia: Preclinical study outcomes Biomedicine and Pharmacotherapy 2025 ; 184 : 117881.
- Dumas-de-la-Roque E., Smeralda G., Quignard JF., Freund-Michel V., Courtois A., Marthan R., Muller B., Guibert C., Dubois M. Altered vasoreactivity in neonatal rats with pulmonary hypertension associated with bronchopulmonary dysplasia: Implication of both eNOS phosphorylation and calcium signaling. PLoS One 2017 ; 12(2) : e0173044.
