Group leader: Laurence Delhaes
Membre du groupe: Raphaël Enaud, Sébastien Imbert, Gauthier Chauvin, Baptiste Defaye
Comme d’autres sites cutanéo-muqueux du corps humain, les voies respiratoires hébergent un microbiome spécifique, entraînant des interactions bénéfiques entre les cellules humaines et leur microbiome (Jaggi et al. 2024 ; Chiu et al. 2017). Le microbiome pulmonaire, que l’on pense stable au moins transitoirement chez les individus en bonne santé, est reconnu comme une flore poly-microorganisme contribuant à la pathogenèse des maladies pulmonaires chroniques telles que la bronchopneumopathie chronique obstructive (BPCO), l’asthme sévère et la mucoviscidose (CF), ou encore d’infections aiguës telles que les pneumonies virales ou les pneumonies acquises sous ventilation mécanique. En retour, ces maladies pulmonaires peuvent modifier la composition du microbiome pulmonaire, augmentant le risque d’infections pulmonaires émergentes ou secondaires. De plus, les voies respiratoires constituent l’une des principales voies d’entrée des agents pathogènes émergents et des maladies infectieuses émergentes (MIE). La majorité des recherches sur le microbiome pulmonaire se sont concentrées sur les bactéries et leur impact sur la santé pulmonaire, cependant d’autres organismes non bactériens (virus ou micromycètes) constituant le virome ou le mycobiome jouent également un rôle physiopathologique important.
Au cours des dernières années, notre groupe de recherche s’est concentré sur l’analyse du mycobiome et microbiome pulmonaires (Imbert et al. 2024 ; Enaud et al. 2023 ; Prevel et al. 2022 ; Delhaes et al. 2018 ; Nguyen et al. 2016), en lien avec la BPCO, l’asthme, la mucoviscidose et les MIE, ainsi que sur ses relations avec l’exposome microbien (Vandenborght et al. 2021).
Projet en cours
Notre objectif principal est de décrypter les relations entre les populations fongiques et bactériennes pulmonaires, l’inflammation, et d’autres covariables telles que les sous-types de maladies respiratoires, l’environnement intérieur (exposome) ou les MIE, en combinant : (i) l’analyse du mycobiome et du microbiome, (ii) l’analyse computationnelle des réseaux inter-règnes et/ou inter-organes (notamment étude de l’axe intestin-poumon), (iii) investiguer la modélisation écologique des flores pulmonaires, (iv) intégrer l’analyse de l’exposome microbien, (v) documenter nos approches par des expériences in vitro et/ou in vivo, et enfin (vi) développer de nouveaux outils d’analyse du mycobiome-microbiome.
Collectivement, ces approches nous permettrons de mettre en évidence et d’analyser la complexité des connexions entre tous les composants bactériens, fongiques et viraux du microbiome respiratoire, ce qui pourrait fournir des éléments clés de compréhension des maladies pulmonaires chroniques et des MIE.
Objectifs principaux
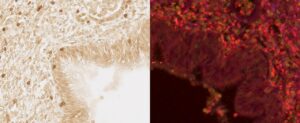
1. Évaluer l’évolution du mycobiome pulmonaire au cours de l’asthme, de la BPCO et de la mucoviscidose, notamment lors des exacerbations;
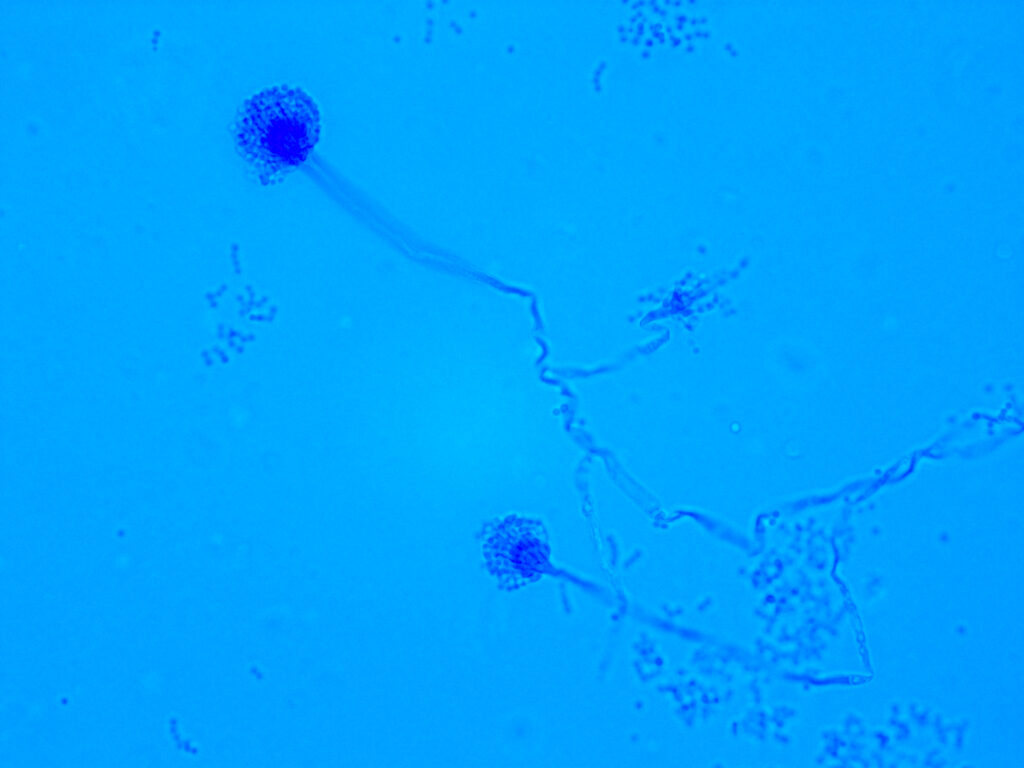
2. Décrypter les complications pulmonaires fongiques spécifiques dans ces maladies, telles que l’asthme sévère avec sensibilisation fongique ou l’aspergillose secondaire, et comprendre comment la composante fongique interagit avec la flore microbienne et/ou les réponses de l’hôte;
3. Étudier la relevance clinique de « l’axe intestin-poumon » dans les maladies pulmonaires chroniques et/ou les MIE;
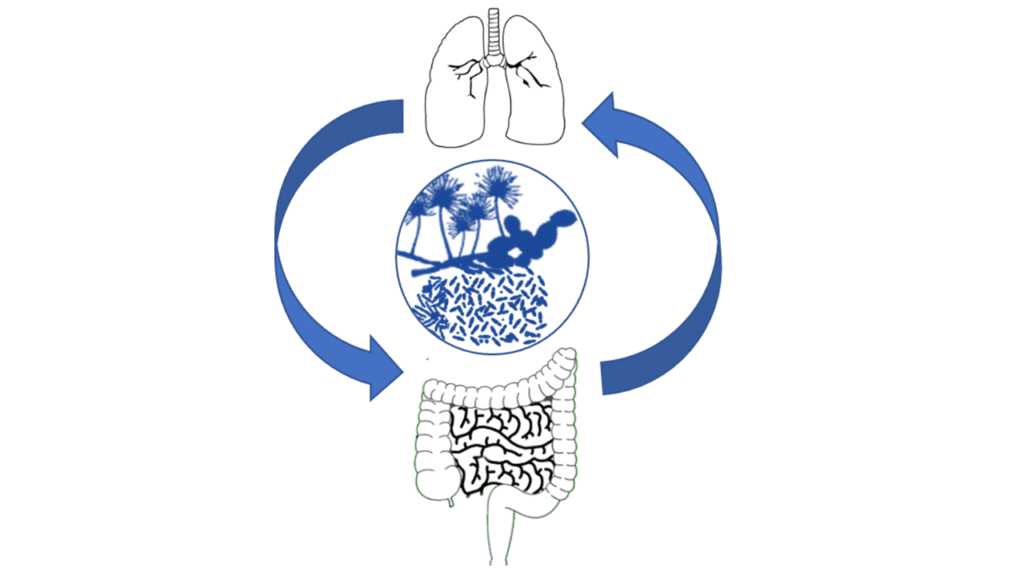
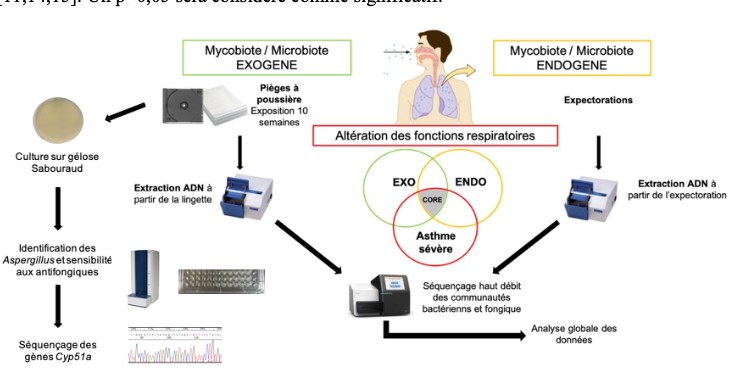
4. Analyser et étudier le rôle du mycobiome exogène (exposome fongique) dans ces maladies;
Principaux financements : ANR « Inf-HOLOBIONT », PSGAR-MIE « EMERG », fonds de VLM, de l’Université de Bordeaux, APITHEM GIRCI SOHO “MyCADO”, Société de Réanimation de Langue Française.
Nos activités de recherche bénéficient aussi du CNR-AspC (Centre National de Référence des Aspergilloses Chroniques -Zone Sud) coordonné par Pr L Delhaes au CHU de bordeaux : https://catbio.chu-bordeaux.fr/prog/defindex.php?idCor=Cor_bf3f2e66996a710964bb86fa77b95446 .
Références
- Imbert S, Revers M, Enaud R, Orieux A, Camino A, Massri A, Villeneuve L, Carrié C, Petit L, Boyer A, Berger P, Gruson D, Delhaes L, Prével R. Lower airway microbiota compositions differ between influenza, COVID-19 and bacteria-related acute respiratory distress syndromes. Crit Care. 2024 Apr 22;28(1):133.
- Jaggi TK, Agarwal R, Tiew PY, Shah A, Lydon EC, Hage CA, Waterer GW, Langelier CR, Delhaes L, Chotirmall SH. Fungal lung disease. Eur Respir J. 2024;64(5):2400803.
- F Lussac-Sorton, É Charpentier, S Imbert, M Lefranc, S Bui, M Fayon, P. Berger, R Enaud, L Delhaes. The gut-lung axis in the CFTR modulator era. Front. cell. infect. microbiol. 2023.
- Enaud R, Sioniac P, Imbert S, Janvier PL, Camino A, Bui HN, Pillet O, Orieux A, Boyer A, Berger P, Gruson D, Delhaes, Pr̩ével R. Lung mycobiota α-diversity is linked to severity in critically ill patients with acute exacerbation of chronic obstructive pulmonary disease. Microbiology Spectrum. 2023 Mar 28:e0506222.
- Prevel R, Enaud R, Orieux A, Camino A, Berger P, Boyer A, Delhaes L, Gruson D. Gut bacteriobiota and mycobiota can both predict day-28 mortality among critically ill patients. Crit care. 2022. 26(1):105.
- Prattes J, Wauters J, Giacobbe DR, Lagrou K, Hoenigl M, ECMM-CAPA Study Group. Diagnosis and treatment of COVID-19 associated pulmonary apergillosis in critically ill patients: results from a European confederation of medical mycology registry. Intensive Care Med 2021; 47: 1158-1160
- LE Vandenborght, R Enaud, C Urien, N Coron, P-O Girodet, S Ferreira, P Berger, L Delhaes. Type 2–high asthma is associated with a specific indoor mycobiome and microbiome. J Allergy Clin Immunol. 2020; 147: 1296-1305.e6.